
Как показало недавнее исследование, опубликованное в Nature, у круглоротых, которые не имеют челюстей, все же есть симпатические нейроны. И челюсти, и симпатические нейроны в ходе эмбриогенеза происходят из клеток…
Новое исследование в Nature пролило свет на хитрый механизм самоочищения мозга! Оказалось, что за поддержание чистоты и порядка ответственны синхронизированные мозговые волны, создаваемые нейронами во время сна –…

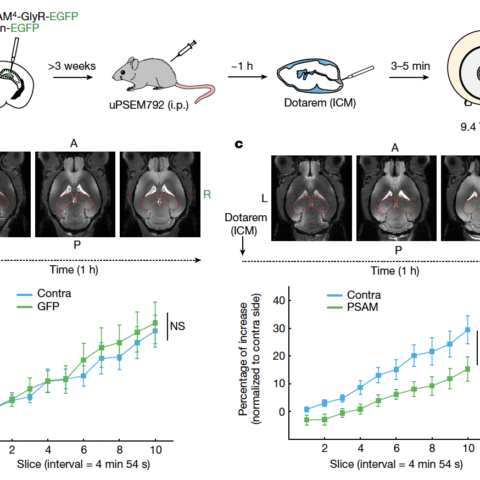
Группа южнокорейских ученых из Центра сосудистых исследований при Институте базовой науки обнаружила уникальную сеть лимфатических сосудов в задней части носа, играющую ключевую роль в дренировании…

В новом исследовании, опубликованном в журнале Nature, исследователи составили карту генетического развития клеток мозжечка человека, мыши и опоссума, и раскрыли некоторые уникальные клеточные характеристики. Одним из…

Ученые из Принстонского университета провели анализ 23433 пар головных нейронов модельной нематоды Caenorhabditis elegans с помощью прямой оптогенетической активации нейронов и одновременной визуализацией кальциевой передачи сигнала в мозге….

В свиязи с активными исследованиями и разработками в области нейроинтерфесов, или интерфейсов мозг-компьютер (brain-computer interfaces, BCI), постепенно начинают возникать вопросы об этическом и правовом статусе таких технологий….

Нейробиологи из Калифорнийского университета в Сан-Диего проанализировали более миллиона клеток человеческого мозга и выявили более 100 различных подтипов, а также обнаружили связи между некоторыми из…

Авторы новой работы, опубликованной в Nature, создали протеомные (белковые) карты для развивающихся синапсов в неокортексе человека, макаки и мыши. Ученым удалось не только детально отследить более тысячи белков,…

Как соотносятся сложность мелодии певчей птицы с ее интеллектуальными способностями? Ученые из Рокфеллеровского университета (США) провели серию поведенческих экспериментов на более чем 20 видах североамериканских…

Тестовую версию нового речевого интерфейса мозг-компьютер, который помогает людям, утратившим возможность общаться с окружающими, представили исследователи из Калифорнийского университета в Лос-Анджелесе (США). Главная особенность этого ИМК –…

В свежей статье в Nature исследователи из Гарвардской медицинской школы (США) раскрыли специфическую активность соматостатиновых нейронов задней теменной коры мышей во время навигационного поведения. Оказалось, что эти клетки становятся…

Классическая нейробиологическая теория о влиянии коннектома на функции мозга предполагает, что динамика нейронов зависит от взаимодействия между специализированными нейронными пулами, связанными сложной сетью аксонов. Однако…