Новый год на портале Neuronovosti.Ru мы начинаем с очередного обзора ведущих журналов. Сегодня мы расскажем вам о молекулярных механизмах аутизма, новом предположении о патогенезе болезни Альцгеймера, а также подробности механизмов сна и бодрствования и функций чувствительных клеток.
Благодаря бурному развитию омиксных технологий (геномики, эпигеномики, транскриптомики, протеомики) мы можем смотреть на болезни в новом ключе – как следствия поломок функционирования клеток организма, нарушения в молекулярных клеточных процессах.
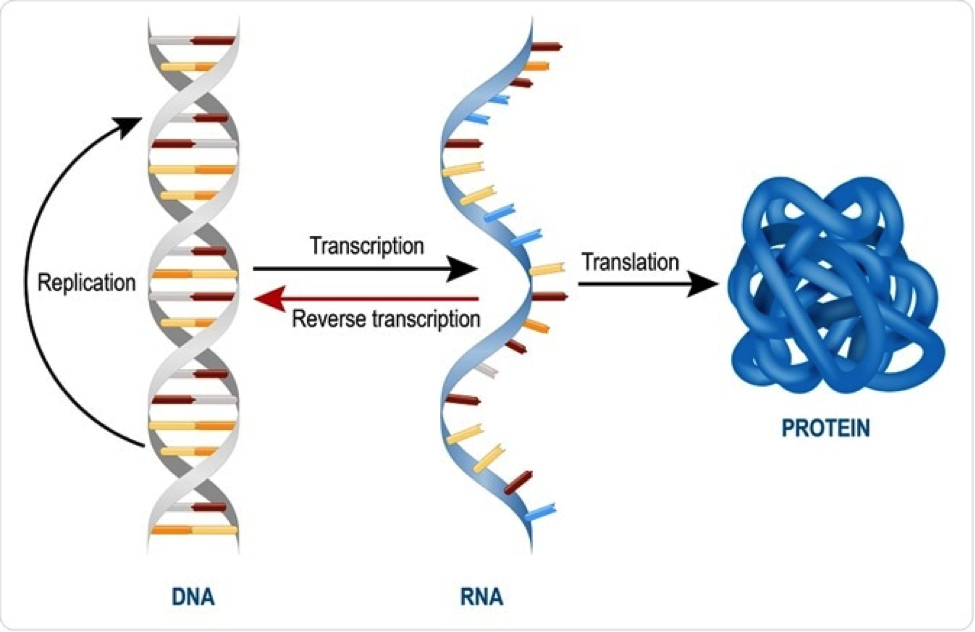
Упрощенная схема процесса, в ходе которого из ДНК при транскрипции получается РНК, которая затем при помощи трансляции становится белком.
Группа американских ученых применила транскриптомные методы, чтобы изучить особенности редактирования РНК в нейронах людей, страдавших от аутизма и близких расстройств. Под редактированием РНК понимают химические модификации РНК после транскрипции, которые могут, например, превращать азотистое основание аденин (А) в инозин (I) (редактирование А – I). Выяснилось, что у людей с аутизмом РНК многих генов, участвующих в синаптической передаче, не подвергаются редактированию, необходимому для их правильной трансляции в белки.
Оказалось и то, что белки, которые не синтезируются или синтезируются в недостаточном количестве при синдроме ломкой X-хромосомы (генетическое заболевание, часто сопровождающееся аутизмом) взаимодействуют с ферментами, превращающими А в I. Кроме того, при аутизме и синдроме ломкой X-хромосомы наблюдаются похожие нарушения в редактировании РНК, что указывает на схожие молекулярные основы этих заболеваний. Таким образом, аутизм и родственные ему расстройства, вероятнее всего, сопровождаются именно нарушениями в редактировании РНК.
Tran, S. S., Jun, H.-I., Bahn, J. H., Azghadi, A., Ramaswami, G., Van Nostrand, E. L., … Xiao, X. (2018). Widespread RNA editing dysregulation in brains from autistic individuals. Nature Neuroscience, 22(1), 25–36. doi:10.1038/s41593-018-0287-x
Под эпигенетикой понимают химические модификации ДНК и белков-гистонов, которые упаковывают ДНК в своеобразные «мешочки» – нуклеосомы. Хотя сама последовательность ДНК остается одной и той же, модификации ДНК и гистонов играют огромную роль в регуляции экспрессии («активности») генов. Не замешана ли эпигенетика и в развитии болезни Альцгеймера?
Оказалось, что белок тау, накопление которого представляет собой характерную черту болезни Альцгеймера, оказывает колоссальное влияние на эпигеном клетки. Он регулирует ацетилирование (присоединение остатка уксусной кислоты) к остатку аминокислоты лизина в гистоне H3. Значительные эпигенетические изменения влияют на структуру хроматина, а также на его взаимодействие с ядерной пластинкой, которая, по сути, формирует «каркас» клеточного ядра.
Возможно, малые молекулы, которые или не дают белку тау менять эпигеном клетки, или блокируют шапероны, необходимые для правильной укладке этого белка, смогут как минимум затормозить развитие болезни Альцгеймера.
Klein, H.-U., McCabe, C., Gjoneska, E., Sullivan, S. E., Kaskow, B. J., Tang, A., … De Jager, P. L. (2018). Epigenome-wide study uncovers large-scale changes in histone acetylation driven by tau pathology in aging and Alzheimer’s human brains. Nature Neuroscience, 22(1), 37–46. doi:10.1038/s41593-018-0291-1

Группа ученых из Великобритании и Китая обнаружила, что вентральная зона покрышки участвует в регуляции сна и бодрствования. Активация у мышей нейронов, выделяющих глутамат или оксид азота NO(да-да, он тоже нейромедиатор), приводила к бодрствованию, и исследователи выяснили, что медиаторы действовали на прилежащее ядро и гипоталамус. Напротив, активация выделяющих ГАМК нейронов в вентральной зоне покрышки давала длительный сон, лишенный REM-фазы.
Исследователи предположили, что ГАМК-ергические нейроны вентральной зоны покрышки подавляют бодрствование, угнетая активность глутаматных и/или дофаминовых нейронов или действуя на гипоталамус. Таким образом, вентральная зона покрышки регулирует не только поведение, но также сон и бодрствование.
Yu, X., Li, W., Ma, Y., Tossell, K., Harris, J. J., Harding, E. C., … Wisden, W. (2018). GABA and glutamate neurons in the VTA regulate sleep and wakefulness. Nature Neuroscience, 22(1), 106–119. doi:10.1038/s41593-018-0288-9
Механизм работы клеток Меркеля
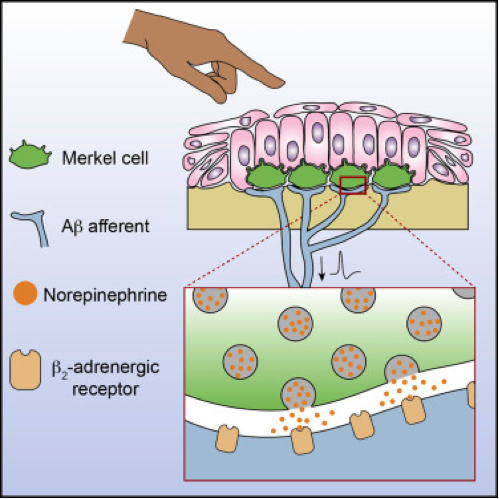
Credit: Abul-Husn N.S. et al. / Neuron
Клетки Меркеля – это механорецепторы кожи, которые реагируют на слабые силовые воздействия. Секвенирование РНК клеток Меркеля показало, что в этих клетках экспрессируются (производятся) белки, необходимые для синтеза норадреналина. Также исследователи показали, что клетки Меркеля выделяют наружу флуоресцентные аналоги норадреналина.
Также норадреналин в клетках Меркеля выделяется в виде везикул, которые сливаются с пресинаптической мембраной, выпуская молекулы нейромедиатора в синаптическую щель. Норадреналин, выделяемый клетками Меркеля, связывается с β2-адренергическими рецепторами.
Hoffman, B. U., Baba, Y., Griffith, T. N., Mosharov, E. V., Woo, S.-H., Roybal, D. D., … Lumpkin, E. A. (2018). Merkel Cells Activate Sensory Neural Pathways through Adrenergic Synapses. Neuron. doi:10.1016/j.neuron.2018.10.034
Обозреватель: Елизавета Минина